Voilà un petit moment déjà que j'avais ce projet en tête : la myrmécovanne.
J'ai toujours trouvé que le problème principal des nids précreusés actuels est qu'on cherche à offrir un maximum de place à la colonie, qui va commencer par stocker ses déchêts dans les salles inoccupées plutôt que dans l'ADC, avant de s'accoître pour finalement avoir besoin de ces mêmes salles devenues entre temps insalubres et attirant par la même occasion les parasites et moisissures, compromettant la colonie...
J'ai longtemps pensé que les nombreux commerçants profitant du "buisness fourmi" trouveraient rapidement une solution à ce défaut de conception, mais finalement j'ai décidé de me lancer il y a quelques semaines, ayant besoin d'un nid pour cette colonie. J'ai donc commencé par chercher des idées : cherchant à créer un système s'intercalant entre deux salles et permettant DE L'EXTERIEUR d'autoriser l'accès ou non d'une salle à la colonie, je suis d'abord parti sur une simple languette à glisser (trop fragile vu l'épaisseur nécessaire et la fente laissée libre lorsque la languette est absente pourrait faciliter les évasions), puis sur une sorte de vis (qui n'existe pas malheureusement), avant enfin de me rappeler d'une petite pièce qu'on trouve souvent dans les cartons des meubles à monter soi-même : le baril-écrou (appelé parfois goujon ou cible-objectif).
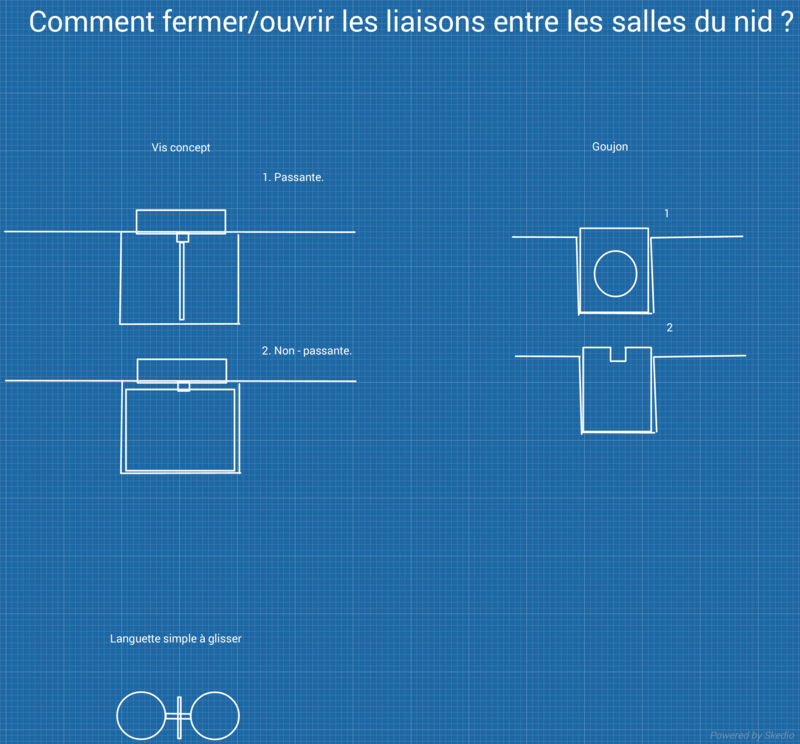
Tenant une base, je suis passé à la schématisation, et ça donne ça :

A ce stade, le concept de "myrmécovanne" restait à perfectionner ! Pourquoi ? Parce qu'en retournant accidentellement le nid, le baril-écrou sortirait de son emplacement et libèrerait la colonie... Donc il a fallu trouver le moyen de garder le baril-écrou dans le nid, mais d'y avoir tout de même accès de l'extérieur pour ouvrir ou fermer la myrmécovanne ! Voilà le résultat (en orange, c'est une rondelle de caoutchouc qui permet de plaquer le baril-écrou contre la vitre du nid, de sorte qu'il n'y ait pas d'interstice par lequel les fourmis puissent se faufiler vers l'extérieur ou vers les salles interdites) :
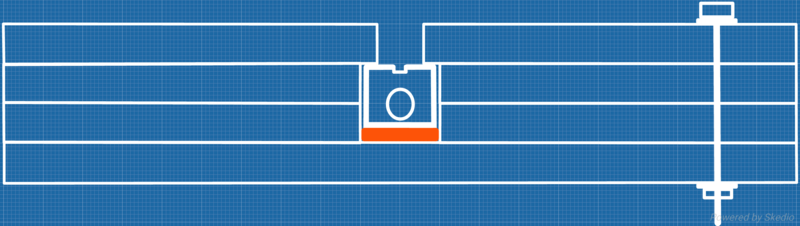
La myrmécovanne est née ! En un coup de tournevis, ma gyne ayant fondé dans une salle près de l'humidificateur et commençant à se sentir à l'étroit avec ses 150 ouvrières, se trouve soulagée, et ce, sans construire de nouveau nid ! Je me suis donc lancé sans plus attendre dans la conception d'un nid expérimental qui dans mon cas doit entrer dans ma cave à vins pour la diapause (l'idée désormais est de créer d'un coup un nid pouvant accueillir une colonie adulte, puisque grâce au système de myrmécovannes, il pourra accueillir la colonie de la fondation à sa "taille adulte", ce qui peut représenter un nid de 1m² voir plus, lorsqu'il n'y a pas la contrainte de la cave à vins...), et après plusieurs heures de calculs et dessins, voilà la bête :

Passons donc de la théorie à la pratique ! Et pour la réalisation, il m'a fallu pas mal de matériel... J'ai donc listé le matériel nécessaire et établi un protocole (le but de ce billet étant d'aider d'autres éleveurs à créer leurs propres nids à myrmécovannes).
Pour construire ce nid, il m'a fallu :
- Une plaque de plexiglas 4mm de 20x20cm;
- Deux plaques de PVC rigide gris 20x20cm;
- Des boulons Ø3x25mm;
- Des rondelles très petites adaptées aux boulons (protéger la vitre);
- Une scie-cloche Ø 3,2cm;
- Un foret à plastique/bois (mèches humidificateur) Ø 0,1cm;
- Une visseuse qui fait perçeuse;
- De la mousse oasis;
- Un fer à souder;
- Du mastic pour aquarium (pour les bouchons) - utiliser du tuyau;
- Un foret à plastiques pour les liaisons (de même diamètre que le diamètre interne des barils-écrous);
- Du tuyau transparent Ø8-10mm;
- Une ADC adaptée à la cave à vins (20x20x7,5-8cm);
- Un foret à bois 9.5mm pour les sorties;
- Un foret à bois 10mm (barils-ecrous);
- Un foret bois Ø 0,3mm pour prépercer boulons;
- Deux Serres - joints;
- Un pistolet pour le mastic;
- Des puits - objectifs (barils-ecrous) 10*14*6mm;
- Un compas cutter circulaire;
- Un cutter de précision;
- Une règle en métal;
- De l'enduit de réparation microfibré "adapté extérieur";
- Un foret bois Ø4mm (trous humidificateur);
- Un foret à découper;
- Une Dremel;
- Un mandrin Dremel;
- Une table bricolage;
- Un kit découpe pvc Dremel;
- Dne poignée de precision dremel;
- Des disques à découper le plexi pour dremel;
- Des joints circulaires 9,5×8×2mm;
A noter : J'ai remplacé trois des quatre plaques de plexi visibles sur la photo suivante par deux plaques de PVC, la matériau correspondant d'avantage à mon outillage.




Le protocole à suivre :
- Tracer les salles (compas-cutter) et liaisons, les emplacements de vis, les sorties et l'humidificateur sur la plaque PVC centrale (marques fines au cutter de précision).
- Poser une plaque PVC centrale sur une planche en bois surélevée de deux tasseaux et la maintenir au support avec des serres - joints. La partie à découper doit être dans le vide.
- Bien marquer l'emplacement de l'humidificateur puis percer au foret "disque" en mettant le pvc dans le sens de la rotation du disque pour éviter les ratés si le disque se déplace sur le pvc (Dremel + grip de précision) OU percer avec le kit de découpe PVC de Dremel.
- Salles : Percer un petit trou central de ø4mm puis percer lentement avec le forêt scie-cloche (visseuse) en démarrant la visseuse une fois le forêt posé sur le centre de la salle. Accélérer progressivement la rotation.
- Utiliser le forêt de 10mm pour percer les emplacements qui recevront les barils-écrous dans la plaque centrale (visseuse). Les barils-écrous ne doivent pas jouer dans leur emplacement (percer un peu petit) et il faut que les espaces de sortie (les percer après l'encastrement des barils-écrous avec le forêt à découper ou un forêt à bois 6mm [Dremel]) soient adaptés au passage dans le baril-écrou. L'encastrement doit être un peu plus profond que la hauteur du baril-écrou (et donc attaquer la plaque PVC inférieure) pour placer une rondelle en caoutchouc dans le fond de sorte de plaquer le baril-écrou contre la vitre supérieure.
- Le trou permettant de passer le tournevis dans la plaque plexi supérieure doit être d'un diamètre inférieur à celui du baril-écrou et bien centré dessus (visseuse).
- Tracer les emplacements des boulons au cutter de précision sur la plaque plexi supérieure.
- Utiliser le forêt de 3mm pour percer les emplacements à boulons en superposant progressivement les 3 plaques.
- Repasser le forêt de 3mm dans les 3 plaques superposées dans les emplacements des boulons pour perfectionner.
- Superposer les 2 plaques inférieures et thermosouder le fond et les bords de l'humidificateur pour le rendre étanche.
- Percer les mèches (Dremel + forêt bois 1mm + grip de précision) en pente montante vers les salles partant du bas de l'humidificateur en perçant depuis les salles (attention aux bords des salles voisines avec le mandrin).
- Thermosouder les bords et le fond des salles et liaisons.
- Tracer les trous d'humidification sur la plaque plexi supérieure puis percer (non superposée aux autres) (Dremel + forêt bois 4mm).
- Découper les restes des liaisons dans la plaque PVC centrale avec le forêt - disque (Dremel + grip de précision).
- Peaufiner le tout délicatement au cutter de précision.
- Placer les rondelles de caoutchouc, les barils-écrous, superposer les 3 plaques, placer les boulons et une rondelle métallique des deux côtés du plexi puis serrer le tout.
- Percer les sorties vers l’extérieur du nid avec le forêt a bois 9,5mm (visseuse) (le tuyau doit être serré). Tenir le nid avec toutes les plaques fixées et vissées, verticalement, et poser la visseuse par - dessus. Accélérer progressivement la rotation.
- Poncer toutes les parties qui recevront l'enduit avec la Dremel + forêt brosse à métaux.
- Couler l'enduit sur une épaisseur de 0,2-0,3mm dans la partie habitable SANS BULLES (tapoter pendant la prise).
- Laisser sécher 48h.
- Plaquer la mousse florale contre l'humidificateur. Appuyer légèrement pour marquer la mousse florale.
- Découper la marque laissée dans la mousse florale (cutter de précision), puis encastrer le bloc dans l'humidificateur et découper au ras de l'humidificateur.
- Découper des chutes de 2x2cm (Dremel + disque) et les percer au centre (Ø10mm) puis plaquer perpendiculairement aux sorties sur les 3 plaques superposées et vissées, contre les sorties, bien centré, et thermosouder UNIQUEMENT AUX 2 PLAQUES INFÉRIEURES !!
- Utiliser des bouts de tuyaux de 2cm de long, les poser verticalement sur du papier d'aluminium, les remplir de Mastic et laisser un peu dépasser plus large que le tuyau. Laisser sécher.
- Faire des bouchons aussi pour l'humidificateur et les accès aux barils-écrous.
- Une fois les bouchons secs, les mettre dans les sorties du nid non – utilisées, les trous de l’humidificateur et les accès aux vannes à fourmis et relier les autres sorties à l'ADC.
- Introduire la colonie.
Quelques photos maintenant pendant la réalisation du nid :






Et après de longues heures de travail, j'ai enfin terminé le tout premier nid doté de myrmécovannes !


Le système est très simple à utiliser : ici la myrmécovanne vue de dessus gère la liaison entre deux salles :

L'accès à la salle suivante est ici impossible...

Mais un demi tour de tournevis plus tard, les deux salles communiquent !

Une ouvrière Serviformica de ma colonie a eu le privilège d'essayer le nid, et apparemment il plait !

Mes regrets sont d'avoir découpé la plaque PVC centrale autour des myrméco-vannes (il aurait été plus simple de juste percer un petit trou des deux côtés du baril-écrou) et de ne pas avoir su faire "plus propre" côté finitions !
EDIT :
En fait dans la liste de mes "améliorations" des nids plexi, au fur et à mesure de mes élevages j'ai choisi de thermosouder l'interstice entre la plaque inférieure et la plaque centrale, et ce, dans le but d'éviter que de la matière organique liquide ne coule des dépotoirs vers cet interstice. Par capillarité le liquide organique se répand alors sur toute la surface d'entre-plaques et y reste très longtemps et s'y décompose, libérant des gaz nocifs pour la colonie et se révélant être une véritable boite de pétri sous les pattes des fourmis... bref mauvais plan.
Aussi je tiens à souligner que contrairement à ce qu'on lit souvent, la capillarité qu'il peut y avoir de "bénéfique" entre l'humidificateur et les salles s'estompe rapidement puisque (du moins pour le genre Formica) les fourmis ont le réflexe de boucher l'arrivée d'eau avec de petits débris... par conséquent ces derniers se décomposent et "infectent" l'espace situé entre la plaque supérieure et la plaque centrale. DONC l'idéal est de percer simplement un trou de très petit diamètre, orienté vers le bas de l'humidificateur (en partant de la paroi située dans une salle contre l'humidificateur) de sorte que l'eau ne coule pas dans le nid, et avant ça de thermosouder totalement l'encastrement de l'humidificateur ! Bref, faire une sorte de conduit d'évaporation.
Cinq astuces :
- Pour les mèches, il n'y a pas de forets assez fins pour empêcher une Solenopsis de passer (par exemple), donc prenez une aiguille toute bête et faites tourner la perceuse assez vite pour fondre le matériau.
- Pour vérifier l'étanchéité de l'encastrement de l'humidificateur (avant d'avoir percé les mèches), il suffit... de le remplir d'eau (la mousse oasis n'est pas encore installée), et de poser le nid délicatement sur de l'essuie-tout. Une heure plus tard, si il y a des gouttes sur l'essuie-tout, c'est que l'étanchéité est mal faite.
- Pour les espèces qui stressent facilement et produisent une grande concentration d'acide (Formica sensu-stricto sp. ou encore Lasius fuliginosus), il suffit de percer des aérations en cercle sur chaque salle dans la plaque supérieure du nid (de sorte de ne pas gêner un éventuel appareil photo qui photographierai depuis le CENTRE de la salle) sur chaque salle dans la plaque supérieure du nid (voir photo ci-dessous).
- Lorsque la mousse oasis vieillit, l'eau met plus de temps pour pénétrer la surface et on doit attendre que la goutte formée sur le trou de l'humidificateur soit absorbée, ça peut être long... L'astuce c'est de creuser la mousse oasis sues deux tiers de son épaisseur à l'aplomb du trou permettant de l'imbiber, de sorte de créer un petit réservoir fait en mousse oasis qui réceptionnera le contenu de la seringue le temps que l'eau soit absorbée.
- Enfin, lorsqu'une ouvrière parvient à s'échapper, elle cherche souvent à rejoindre la colonie, et ce en passant par l'humidificateur... La parade, c'est soit de séparer la plaque de plexi supérieure en deux de sorte de pouvoir changer la mousse oasis sans ouvrir la partie habitable du nid (un peu lourd quand le ouvrières s'évadent souvent, soit simplement de faire des bouchons en silicone.

Il ne me reste plus qu'à attendre le printemps pour faire emménager la colonie, encore deux mois à attendre...















































